中国有2000万罕见病患者使用救命药物
画龙虎很难画出骨头,基因编辑也在探索这句古话中的出口。利用工具,人类可以在实验室中编辑基因,但在复杂的内部环境中,基因编辑仍然很困难。人类在体内编辑基因还是初学者。
有些初学者已经“升入高等学校”。昨天基因魔剪CRISPR终于突破了“人体”的防线,实现了体内基因编辑。
Intellia治疗学有限公司是CRISPR技术的开创者之一,詹妮弗杜德教授获得诺贝尔化学奖成立生物技术公司。该公司的知名制药公司Regeneron联合宣布,正在研究的CRISPR体内基因组编辑疗法(NTLA-2001)在一期临床试验中取得了积极成果,CRISPR已经安全成功地编辑了患者肝细胞中的DNA。
这意味着我们可以用类似于注射药物的简单方法成功地编辑致病基因,从而治疗疾病,对真正意义上的人类基因发动“精确攻击”,这是名副其实的“里程碑事件”,也是对罕见疾病患者的福音。
见证历史
这项研究的结果发表在《新英格兰医学杂志》。这些数据包括在第一阶段临床试验中接受治疗的6名ATTR患者,其中3人接受了剂量为0.1毫克/千克的NTLA-2001,3人接受了剂量为0.3毫克/千克的NTLA-2001。
在治疗的第28天,NTLA-2001可以以剂量依赖的方式降低患者血清中的TTR水平。TTR在0.1毫克/千克组平均下降52%,在0.3毫克/千克组平均下降87%。一名患者的TTR水平下降了96%。
NTLA-2001有可能治愈甲状腺素运载蛋白淀粉样变性(ATTR)一次。值得注意的是,目前治疗ATTR多发性神经病患者的标准疗法通常会将TTR水平降低80%,患者需要长期治疗,这使得CRISPR在疗效和方便性方面都具有优势。
此外,NTLA-2001在治疗后第28天显示出良好的安全性,并且没有发现严重的不良事件和肝脏问题。所有不良事件均为轻度不良事件(1级)。
Intellia首席科学官劳拉塞普-洛伦齐诺(Laura Sepp-Lorenzino)说:“这反映了我们在临床之前所做的工作。我们探索了一种非常好的剂量依赖效应。在更高的剂量下,CRISPR工具几乎可以到达每个肝细胞。”
“我们一直渴望太空飞行,尽管我们已经进行了第一次太空行走和第一次登月,现在我们要去火星。”加州大学伯克利分校的基因工程师费奥多尔乌尔诺夫(Fyodor Urnov)说:“Intellia解决了CRISPR领域的具体挑战,即将编码Cas9的mRNA脂质纳米粒注射到人体内治疗疾病,这一事实本身就是一个里程碑。”
NTLA-2001是智能管道中的第一个体内基因组编辑治疗项目。目前公司已经开始使用第三队列药物,也将使用更高剂量,所有参与者将接受长达两年的监测。
到今年年底,该公司预计将开始为另一种用于遗传性血管性水肿(一种遗传性肿胀疾病)的CRISPR药物招募患者。但公司高管表示,他们希望这些措施只是开始。”Sepp-Lorenzino说:“它不仅打开了TTR的大门,也打开了治愈其他与肝脏表达蛋白有关的遗传病的窗口。"
基因雷达
NTLA 2001背后的技术支持是什么?
具体来说,NTLA-2001主要使用CRISPR工具来“纠正”患者的患病基因“TTR”。工具一旦到达病变部位,就会切割基因,使其失去功能,阻止受损蛋白不断积累。
虽然这些步骤很简单,看起来也不难,但要让CRISPR进入正确的细胞,就像一艘潜艇在黑暗的深海中前进,它必须用雷达来引导自己。
所以Intellia必须开发一个能把自己的CRISPR投递到合适地方的投递工具,投递决定CRISPR的应用效率。
这个工具就是脂质纳米粒(LNPs)——,脂肪分子的包膜,包裹着携带CRISPR指令的RNA链,帮助它们到达目的地而不被人体免疫系统降解或检测到。我们可以把它当成胶囊药的外衣。
但是裸露的RNA带负电,意味着不能穿透细胞膜。所以Intellia公司开发的LNPs,配有化学开关,使其在中性pH值(如人体内部)时具有中性电荷,但在pH值上升到6的粗糙水平时具有正电荷。
这将极大地推动CRISPR中RNA操作的最后一英里。这使得身体允许LNP穿过肝脏中的肝细胞膜,然后出现在细胞内。
在整个过程中,基因编辑工具会被包裹在脂质纳米粒(LNPs)中,我们的人体会谈论会被识别为胆固醇或者这种脂肪的物质。为了分解这些“脂肪”,人体内部的酸性逐渐被程序化。当酸碱度上升到足够高的水平时,LNP化学公司打开和关闭开关,使分子带正电荷,并将核糖核酸喷射到细胞的细胞质中。
在那里,它可以被核糖体拾取并翻译成CRISPR的两个主要组成部分:一个DNA切割酶和一个用于将其发送到TTR基因的基因GPS指南。
这项技术并不少见。辉瑞公司开发的Moderna和mRNA新冠肺炎疫苗也在利用这一技术实现药物传递,但毫无疑问,这仍然是一种新的生物技术,尚未得到广泛应用。
2018年,第一批LNPs封装的药物被美国吃掉
品和药物管理局(FDA)批准,用于将干扰RNA(RNAi)药物递送到肝脏组织,以治疗转甲状腺素淀粉样变性。在这些器官中,肝脏是一个更容易输送药物的器官,因为肝脏的主要工作是收集和过滤血液,这让其成为LNPs的自然目标,由于其固有的物理特性(大小、电荷、与天然脂肪相似的结构),让需要递送的药物能够更容易的从血液中直达肝脏。
“毫无疑问,LNPs是这里的英雄,因为如果没有它们,CRISPR即使是一项非常令人兴奋的技术,但也不会被充分利用。”麻省理工学院的化学工程师Daniel Anderson说,他也是CRISPR Therapeutics的科学联合创始人。
中国机会在哪里?
2015年,CRISPR/Cas9基因编辑技术被《科学》杂志评为年度十大科技突破之首,这是该技术继2013年之后的再一次入选。
随后,英国用基因编辑方法改 造的细胞治疗技术治愈了白血病。神奇的“基因剪刀”锋芒毕露,作为革命性的技术创新,掀起了学术界、产业界和资本界的巨大浪潮。
CRISPR技术精准编辑、高效便利的特点,使其在疾病治疗领域的应用潜力巨大。目前正在研究利用 CRISPR 治疗多种癌症和遗传疾病,主要有两种途径:一种是将患者细胞进行体外基因校正用于自体移植;另一种是上文的方式,将CRISPR传递到靶器官对细胞进行体内修饰。
在过去的13年中,已经有超过2870个专利家族,包括8500个专利。自从包括Jennifer Doudna所在的CRISPR技术先驱公布关键专利以来,Regeneron, Novartis和Cellectis等公司关于CRISPR技术的专利申请量也大幅增加。
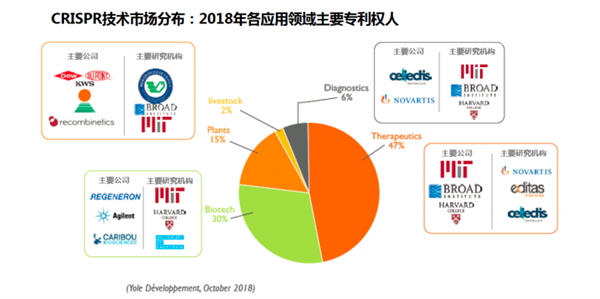
科学界迅速发展,产业界需求旺盛,基因编辑产业已经拥有了自己的土壤。咨询公司BCG的市场调查报告显示,过去五年生物科技领域在基因编辑技术平台上开发的专利技术呈现井喷式增长,2010-2014年复合增长率高达41%。从技术路径上来看,以CRISPR 技术发展最为迅速。
同时,据预测数据显示,2021-2025年,我国基因治疗市场行业规模将从504亿元增长到1208亿元,年复合增长率可达24.4%。
要知道,目前有6000多种疾病被确认与基因组异常相关,包括常见单基因疾病镰刀贫血症、血友病等以及其他罕见病,目前,已发现的罕见病种类多达7000多种,患者人数约为3.5亿,甚至超过了艾滋病于癌症患者的数量。
在我国,罕见病患者的数量也在逐年攀升。2015年,我国罕见病画着总人数约为1680万人,到了2020年,这一数据上涨到2000万人,这些疾病在临床上往往缺少有效治疗方法,基因编辑技术的崛起为饱受痛苦的患者和家庭燃起新的治疗希望。
如今,我们已经过了那个谈基因编辑色变的时代,治疗的方式也不再拘泥于单一的化学药物,生物技术正在大跨步迈上属于自己的舞台。
在未来,你我或许都将是基因编辑的受益人。